Alzheimer ist wohl die bekannteste Form der Demenzerkrankungen. Alleine in Deutschland sind etwa 700.000 Personen davon betroffen. Doch wie entsteht eine Alzheimer Erkrankung eigentlich und wie kann sie diagnostiziert werden?
Wie entsteht Alzheimer?
Die Alzheimer Krankheit ist eine neurodegenerative Erkrankung, die durch das kontinuierliche Absterben von Nervenzellen des Gehirns gekennzeichnet ist. Auslöser dafür ist der Zusammenschluss mehrerer gleicher Einzelbausteine. Diese Einzelbausteine, die sogenannten Amyloid-beta Monomere (Aβ), sind Eiweißfragmente, die ständig während unseres gesamten Lebens bei der Spaltung eines bestimmten Eiweißes freigesetzt werden. Diese einzelnen Aβ-Monomere sind ungefährlich und in jedem Menschen vorhanden. Bei der Alzheimer Erkrankung wird jedoch vermehrt Aβ gebildet, welches nicht schnell genug wieder abgebaut werden kann. Der Überschuss an Aβ-Monomeren hat zufolge, dass sich mehrere dieser Einzelfragmente außerhalb der Nervenzellen zu größeren toxischen Komplexen, den sogenannten Aβ-Oligomeren verbinden. Mit fortschreitender Erkrankung bilden diese Komplexe stabile Verbindungen und entwickeln sich schließlich zu den bekannten Alzheimer-Plaques (siehe Bild 1).
Neuere Studien zeigen jedoch, dass die Aβ-Oligomere die zentralen Treiber des Krankheitsgeschehens sind. Sie lagern sich zwischen den Nervenzellen ab und stören so deren Kommunikation, was letztlich zum Absterben der Nervenzellen führt. Infolgedessen nimmt das Hirnvolumen mit fortschreitender Erkrankung immer weiter ab – d.h. das Gehirn schrumpft.
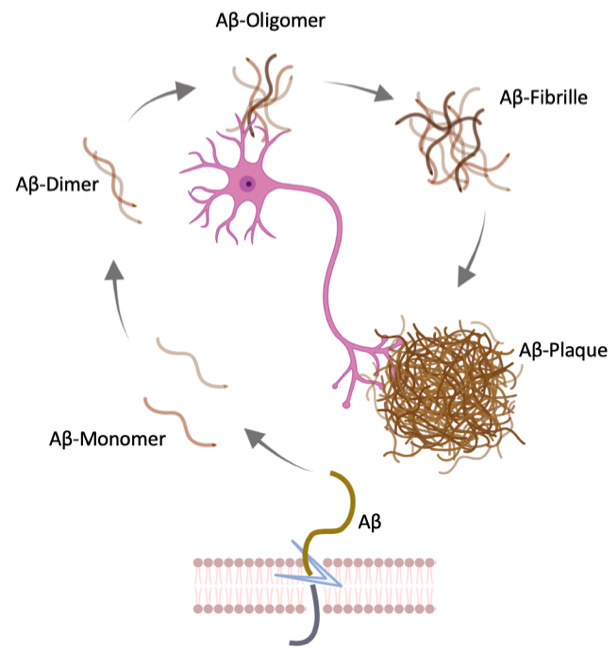
Diese krankhaften Veränderungen des Nervensystems finden schon ganz zu Beginn der Erkrankung statt und wirken sich oft erst nach 5-10 Jahren schrittweise auf das Verhalten der Patient:innen aus. Die ersten äußerlich sichtbaren Symptome sind dann durch Störungen des Kurzzeitgedächtnisses geprägt. Infolgedessen haben die Betroffenen Schwierigkeiten, sich Informationen zu merken und Gesprächen zu folgen. Im weiteren Verlauf der Erkrankung wird auch das Langzeitgedächtnis beeinträchtigt, sodass vergangene Ereignisse und Erlebnisse nicht mehr abgerufen werden können. Auch die räumliche und zeitliche Orientierung nimmt immer weiter ab, weshalb Patient:innen auf Betreuung und Unterstützung bei der Alltagsbewältigung angewiesen sind. Diese Entwicklung geht sogar so weit, dass Patient:innen im Endstadium körperlich immer weiter abbauen und Schwierigkeiten mit dem Sprechen, der Atmung und dem Schlucken haben.
Diagnose
Obwohl Alzheimer bisher noch nicht heilbar ist, gibt es Medikamente, die einige Symptome abschwächen können, jedoch mit Nebenwirkungen einhergehen und den Krankheitsverlauf nicht verlangsamen. Falls es hoffentlich bald wirksame Medikamente geben sollte, die den Krankheitsverlauf verlangsamen können, dann wäre es umso besser, je früher mit der medikamentösen Behandlung begonnen wird. Eine frühe Diagnose ist also sehr wichtig! Das Problem ist aber, dass die Erkrankung häufig erst bemerkt und diagnostiziert wird, wenn anfängliche Verhaltensänderungen klinisch auffällig werden. Zu diesem Zeitpunkt liegt der Beginn der Erkrankung jedoch schon Jahre zurück, in denen es bereits zu massiven Veränderungen im Gehirn gekommen ist (siehe Bild 2).
Zudem sind Symptome wie Vergesslichkeit und Antriebslosigkeit ebenfalls typische Kennzeichnen anderer Erkrankungen, sodass Alzheimer im Anfangsstadium nur anhand äußerlich wahrnehmbarer Anzeichen kaum eindeutig diagnostiziert werden kann. Der Blick auf das Verhalten der Erkrankten alleine reicht also nicht für die frühe Erkennung der Alzheimer-Demenz. Dies hat Dr. Nils Richter in einem Video sehr anschaulich erklärt.
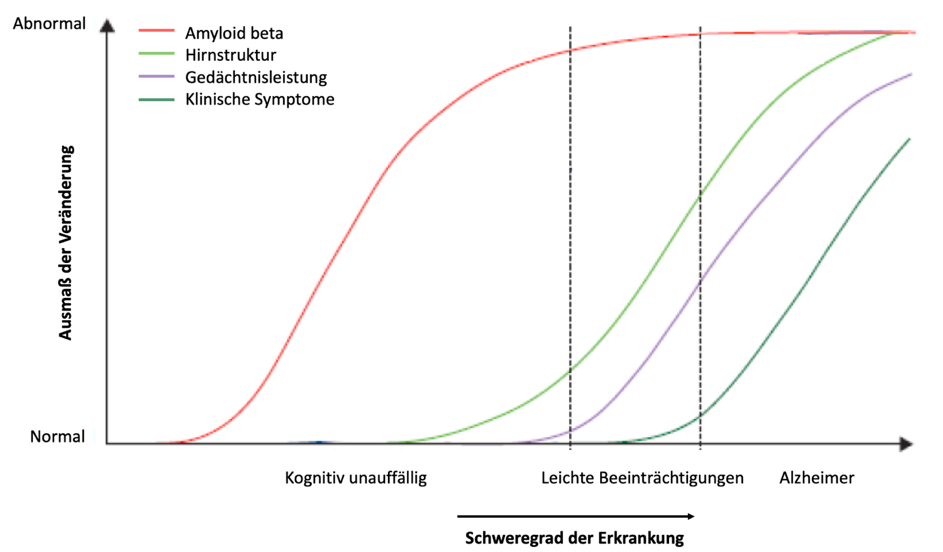
Deshalb ist die Suche nach relevanten körperlichen Frühwarnzeichen, den sogenannten Biomarkern, besonders wichtig für die Frühdiagnose. Als Biomarker bezeichnen wir biologische Merkmale, wie beispielweise spezielle Blutwerte oder die Körpertemperatur, die auf normale oder krankhafte körperliche Prozesse hindeuten. Zusätzlich zu den Biomarkern werden verlässliche Methoden benötigt, mit denen diese quantifiziert werden können, um die Schwere der Erkrankung zu bestimmen. Wissenschaftler:innen des Forschungszentrums Jülich verfolgen derzeit verschiedene Ansätze zur Erforschung verschiedener Biomarker der Alzheimer Erkrankung, von denen zwei im Folgenden vorgestellt werden.
Fahndung in Körperflüssigkeiten
Wie oben bereits beschrieben, wird die Anreicherung mehrerer einzelner Aβ-Monomere zu größeren Aβ-Oligomeren als Auslöser der Alzheimer Erkrankung angesehen. Da das Auftreten der Oligomere eines der frühesten Vorzeichen sein könnte, konzipierten die Wissenschaftler:innen des Instituts für Biologische Informationsprozesse (IBI-7) einen Test, mit dem diese Oligomere in Körperflüssigkeiten wie Blut oder Hirnwasser nachgewiesen werden sollen.
Die Entwicklung des Tests stellte die Forscher:innen jedoch vor zwei wesentliche Herausforderungen, die es zu lösen galt. Da Aβ-Oligomere aus mehreren Monomeren bestehen, muss gewährleistet werden, dass die Methode präzise zwischen diesen beiden Formen unterscheiden kann, damit ausschließlich die toxischen Oligomere identifiziert werden. Zum anderen muss das Verfahren besonders sensitiv sein, um bereits kleinste Mengen erkennen zu können.
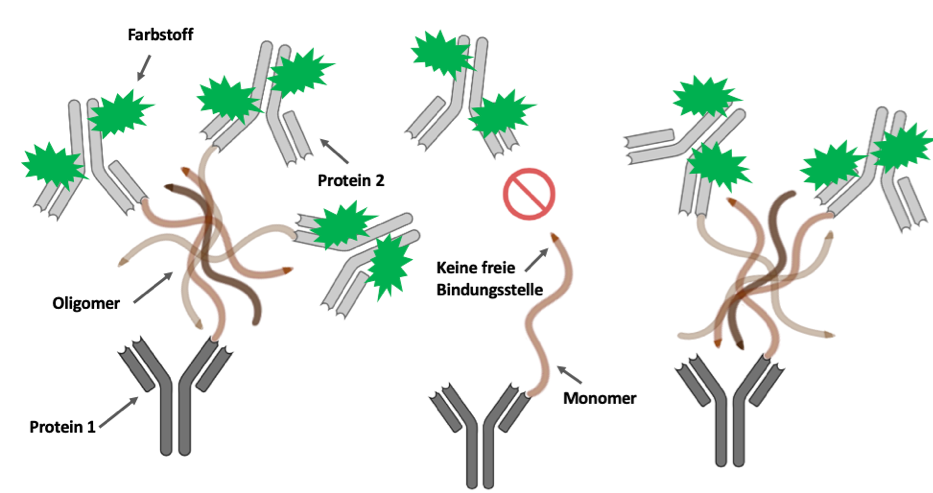
Der Ablauf der sogenannten sFIDA („surface-based fluorescence intensity distribution analysis“) Methode ist schematisch in Bild 3 und in Video 1 dargestellt. Zunächst wird die zu untersuchende Probe auf eine Glasplatte gegeben, auf der sich bereits ein bestimmtes Protein (Protein 1) befindet. Dieses Protein bindet an eine ganz bestimmte Stelle des Aβ (Schlüssel-Schloss-Prinzip). So bleiben nur die Aβ-Oligomere und Monomere auf der Glasplatte zurück und werden infolgedessen von anderen in der Probe enthaltenen Partikeln getrennt.
Als Nächstes wird ein weiteres Protein (Protein 2), welches mit einem Farbstoff (grüne Sterne) markiert ist, zu der Probe hinzugefügt. Dieses bindet an dieselbe Stelle wie das Protein im vorherigen Schritt und macht somit nur die Aβ-Oligomere sichtbar. Der Grund: Monomere besitzen nur eine einzige Bindungsstelle. Diese ist jedoch schon durch das erste Protein blockiert, was eine weitere Bindung mit dem neu hinzugefügten Protein verhindert. Da Oligomere jedoch aus mehreren Monomeren bestehen, haben sie noch freie Bindungsstellen an die das eingefärbte Protein andockt und sie somit „farblich markiert“. Durch den Farbstoff werden diese Verbindungen anschließend unter einem speziellen hochauflösenden Mikroskop sichtbar gemacht. Die Farbintensität ist dabei von der Anzahl der Eiweißverbindungen abhängig. Das heißt, große Oligomere, die viele Bindungen aufweisen, kommen dabei besonders deutlich zum Vorschein.
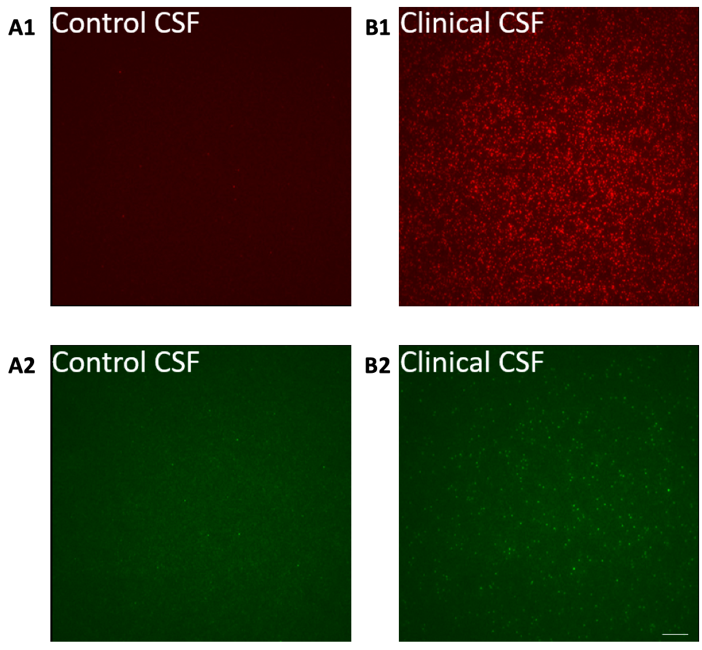
In mehreren Studien wurde bereits gezeigt, dass in Proben von Alzheimer Patient:innen wesentlich mehr Aβ-Oligomere nachgewiesen werden, als bei gleichaltrigen gesunden Personen (siehe Bild 4). Außerdem wurde ein direkter Zusammenhang zwischen dem Ausmaß der kognitiven Beeinträchtigung und der Anzahl der gemessenen Oligomere festgestellt. Das heißt, je schlechter es um die Kognition eines:r Patient:in bestellt war, desto mehr Oligomere befanden sich in den Proben.
Doch was bedeutet das genau? Zum einen wissen wir dadurch, dass anhand der gemessenen Oligomer-Konzentration zwischen Alzheimer Patient:innen und Kontrollpersonen unterschieden werden kann. Die sFIDA Methode könnte also ein vielversprechendes Instrument in der Alzheimer Diagnostik sein. Darüber hinaus scheint die Anzahl der gemessenen Oligomere mit fortschreitender Erkrankung immer weiter zu steigen. Somit würden bereits das Vorhandensein kleinster Mengen ein frühes Vorwarnzeichen einer beginnenden Alzheimer Erkrankung widerspiegeln.
Diese Erkenntnisse sind von zentraler Bedeutung für die Medikamentenforschung. Man weiß jetzt, dass die Anreicherung von Aβ-Monomeren zu größeren Komplexen, den Aβ-Oligomeren, den Krankheitsprozess auslöst und vorantreibt und hat eine verlässliche Methode gefunden, diese frühzeitig nachweisen zu können. Damit ist auch das Zielmolekül bekannt, auf das eine geeignete Therapieform ausgerichtet sein muss. Wissenschaftler:innen des IBI-7 haben deshalb erstmals einen besonderen Wirkstoff entwickelt, der gezielt die toxischen Aβ-Oligomere zerstört und diese wieder in ungefährliche Aβ-Monomere zerlegt. Erste Tests verliefen bereits vielversprechend. Nun wird der Therapieansatz in einer Tochterfirma weiter erforscht.
Bildgebende Biomarker
Ein anderer Ansatz zur Früherkennung wird am Institut für Neurowissenschaften und Medizin (INM-7)erforscht. Wie bereits oben beschrieben, kommt es bei der Alzheimer Erkrankung noch vor dem Auftreten klinischer Symptome zu einem vermehrten Verlust von Gehirnsubstanz. Mit dem Magnetresonanztomografen (MRT) können Schnittbilder des Gehirns erzeugt und so Gewebeabbau und Veränderungen der Hirnstruktur entdeckt werden. Allerdings sind diese Hirnveränderungen selbst für eine*n erfahrene*n Radiolog:in im frühen Stadium der Erkrankung nur sehr schwer zu erkennen.
Auch das gesunde Gehirn unterliegt im Laufe des Lebens gewissen Alterungsprozessen. Diese sind jedoch im Vergleich zu denen der Alzheimer Erkrankung erheblich schwächer und in anderen Bereichen des Gehirns ausgeprägt. Dadurch könnten Unterschiede des regionalen Hirnvolumens ein frühes Anzeichen einer Erkrankung sein. Wissenschaftler:innen des INM-7 entwickeln derzeit innovative Ansätze des maschinellen Lernens (d.h. Algorithmen), mit denen frühe Alzheimer-typische Hirnveränderungen identifiziert werden können, die für das menschliche Auge nicht sichtbar sind.
Hierfür nutzen sie die Hirnscans von mehreren Hundert gesunden und an Alzheimer erkrankten Personen. Anhand dessen bestimmen die Wissenschaftler:innen das individuelle Volumen von über 100 Hirnregionen – und das für jede einzelne Person. Das Ziel der Vorgehensweise ist, dass ein Algorithmus nur anhand dieser Volumenangaben den Gesundheitsstatus (d.h. ob eine Alzheimer Erkrankung vorliegt oder nicht) einer Person erkennen soll.
Dazu wird der Algorithmus sowohl mit den Bildgebungsdaten (d.h. das individuelle Volumen jeder einzelnen Hirnregion) als auch mit der Zielvariable, die später vorhergesagt werden soll (d.h. liegt eine Alzheimer Erkrankung vor oder nicht) vieler Personen „gefüttert“, um zunächst in mehreren Trainingsrunden unterliegende Muster oder Zusammenhänge in den Daten zu erkennen. Der Algorithmus wird so trainiert und weiterentwickelt, dass er fähig ist, anhand dieser Trainingsdaten allgemeingültige Zusammenhänge und Regeln aufzustellen, die auf neue Personen übertragbar und anwendbar sind.
Bemerkenswert war, dass der entwickelte Algorithmus in 91% der Fälle den Gesundheitszustand einer Person nur anhand ihres Hirnscans korrekt klassifizieren konnte. Es hat sich herausgestellt, dass das gemeinsame Zusammenspiel der Volumina verschiedener Hirnregionen für die korrekte Bestimmung des Gesundheitsstatus entscheidend ist (siehe Bild 5). Dieses Vorgehen scheint also Muster in den Hirnscans von Alzheimer Patient:innen zu identifizieren, die für das menschliche Auge nicht sichtbar sind. So könnten beginnende Alzheimer-typische Veränderungen in der Hirnstruktur wesentlich früher erkannt werden.
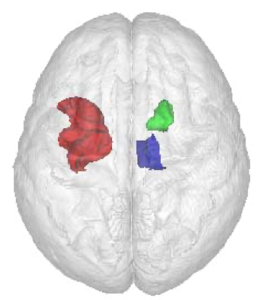
Bild 5. Die kombinierte Betrachtung der Volumina dreier Gehirnregionen (hier in rot, blau und grün) konnte die Vorhersagegenauigkeit des Gesundheitsstatus einer Person erheblich verbessern.
Das Ziel der Wissenschaftler:innen des INM-7 ist es, dieses Verfahren weiter zu entwickeln und dessen Genauigkeit zu verbessern, damit es zukünftig als zusätzliches Diagnoseverfahren Anwendung in der klinischen Praxis findet. Gegenüber der aufwendigen und zeitintensiven Diagnosemethoden, die gegenwärtig zum Einsatz kommen, vereinfacht die Nutzung modernster Algorithmen diesen Prozess erheblich. Die Auswertung eines Hirnscans mithilfe des Algorithmus ist unkompliziert und soll nur wenige Minuten dauern. Diese erhebliche Zeitersparnis ist ein klarer Vorteil, von dem sowohl der / die behandelnde Kliniker:in als auch der / die individuelle Patient:in profitiert. Eine Untersuchungsmethode, die wenig Aufwand und Zeit in Anspruch nimmt, stellt eine geringere Belastung dar als die herkömmlichen langwierigen Untersuchungen verschiedener Fachärzt:innen. Dadurch könnte die Hemmung bereits bei ersten Anzeichen eine:n Arzt:in zur Abklärung aufzusuchen, gemildert und eine Alzheimer Demenz früher erkannt und behandelt werden.
Fazit
Eine möglichst frühe Erkennung einer vorliegenden Alzheimer Demenz ist wichtig. Nur so können rechtzeitig wichtige Maßnahmen ergriffen und medikamentöse Behandlungen zur Verlangsamung des Krankheitsprozesses eingeleitet werden. Allerdings stellt dies derzeit noch gewisse Herausforderungen dar. Verhaltensänderungen werden oft erst auffällig, nachdem es bereits zu beträchtlichen Hirnschäden gekommen ist. Es braucht also Biomarker und Methoden, um diese zu quantifizieren, damit körperliche Veränderungen, die mit einer beginnenden Alzheimer Demenz einhergehen, schon vor dem Auftreten erster äußerlicher Symptome nachgewiesen werden können. Wissenschaftler:innen des Forschungszentrums Jülich verfolgen dabei verschiedene Ansätze. Studien zur Untersuchung von Körperflüssigkeiten und Hirnscans zeigten bereits vielversprechende Resultate. Das Ziel ist es, diese Verfahrensweisen nun weiterzuentwickeln und zu verbessern, damit diese in Zukunft in der klinischen Anwendung den Diagnoseprozess unterstützen können. Befunde sollen so schnell und unkompliziert sein und dadurch die Ängste und Hemmungen der Patient:innen lindern. Denn schließlich steht das Wohl der Patient:innen immer an erster Stelle.
Hinweis: Weitere Beiträge zur Alzheimer Forschung finden Sie unter:
oder in den Sozialen Medien unter dem Hashtag #FZJAlzheimer

No Comments
Be the first to start a conversation