In biotechnologischen Produktionsprozessen werden Mikroorganismen mit außergewöhnlichen Eigenschaften eingesetzt. Sie stammen z.B. aus dem Boden, dem Verdauungsapparat, von Pflanzenoberflächen oder aus dem Wasser. Im Labor lebt eine solcher Mikroorganismus in einem gerührten Gefäß mit ca. 0,5-20 L Volumen (sogenannten Bioreaktoren). Hier werden alle Umgebungsbedingungen präzise kontrolliert. Für die darin lebenden Mikroorganismen ist ein solcher Bioreaktor das reinste Schlaraffenland: Es gibt Nahrung im Überfluss, die Temperatur ist im Wohlfühlbereich und an Luft zum Atmen mangelt es auch nicht.

DASbox Mini-Bioreaktor (Quelle: Eppendorf AG Bioprocess Center)
Um die high-performer unter den Mikroorganismen zu finden, werden sie zunächst im Labormaßstab untersucht, getestet und trainiert. Dieser Auswahlprozess liefert potentielle Kandidaten. Aber um sicher zu gehen, dass Sie ihrer zukünftigen Aufgabe im Produktionsprozess gewachsen sind, muss man den Maßstab der Kultivierung vergrößern – bei Produkten mit großem Produktionsvolumen (z.B. Aminosäuren, Antibiotika oder Enzymen) sogar ganz gewaltig. Die größten Produktionsbioreaktoren fassen heute über 500 Kubikmeter, das ist in etwa so viel wie ein 25m-Schwimmbecken fasst. Man würde vermuten, dass es für Mikroorganismen keinen Unterschied macht, ob sie in einem Wasserglas oder einem Schwimmbecken wohnen, also in einem kleinen oder großen Bioreaktor. Leider falsch, denn aus Erfahrung wissen wir, dass viele mikrobielle Produktionsstämme im Produktionsbioreaktor ihre Leistungsfähigkeit teils erheblich einbüßen. Die Folge sind enorme wirtschaftliche Risiken bei der Entwicklung von Bioprozessen.
Wie kommt es, dass die ca. 2-10 Mikrometer großen Lebewesen merken wo sie sich aufhalten? Die Umgebungsbedingungen im großen Bioreaktor sind leider doch nicht so konstant wie im Labor. Der Sauerstoffgehalt ist nicht an allen Orten gleich und die Substratversorgung lässt sich eher mit Intervallfasten nach dem Zufallsprinzip vergleichen. Eine wirtschaftlich vertretbare technische Lösung für dieses Dilemma gibt es leider nicht, denn das Durchmischen von 500.000 Liter Flüssigkeit mit einem Rührer gleicht einer Herkulesaufgabe. Die Ingenieure stoßen hier an technische Grenzen.
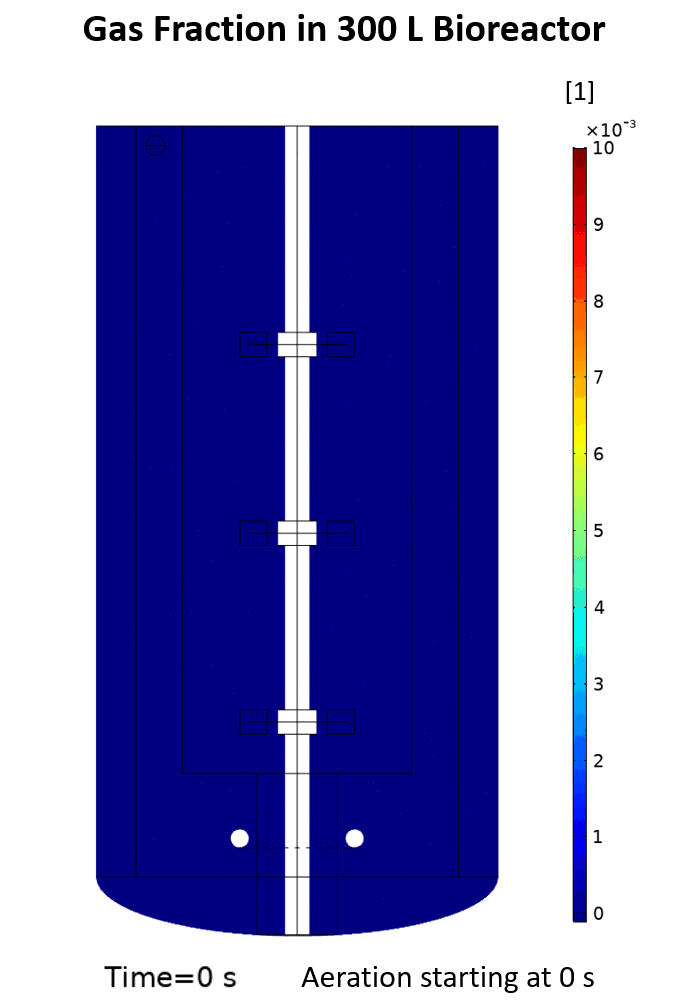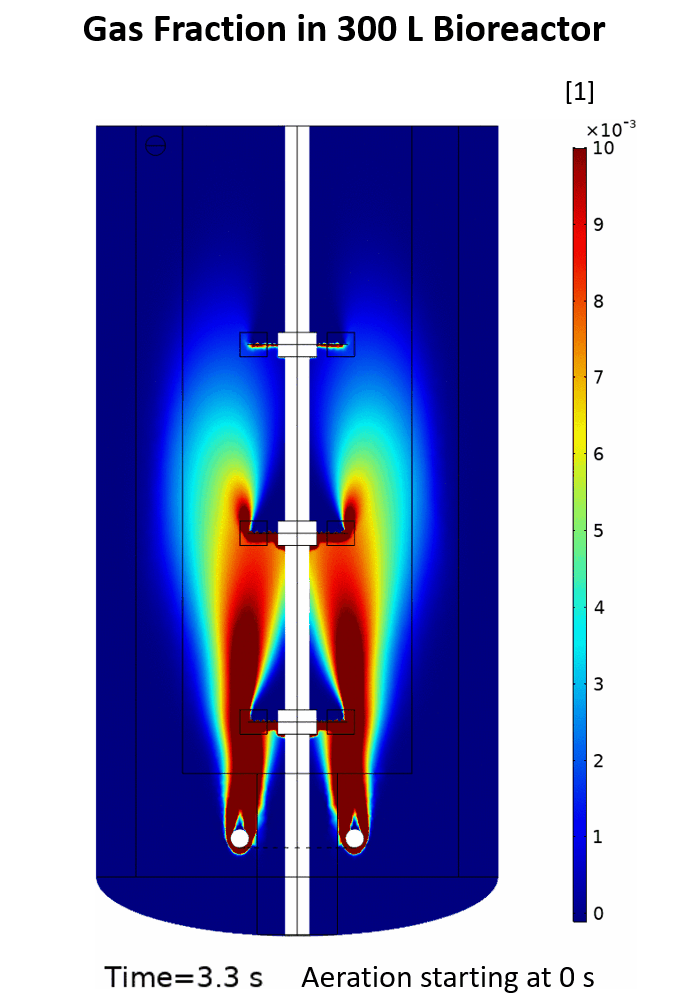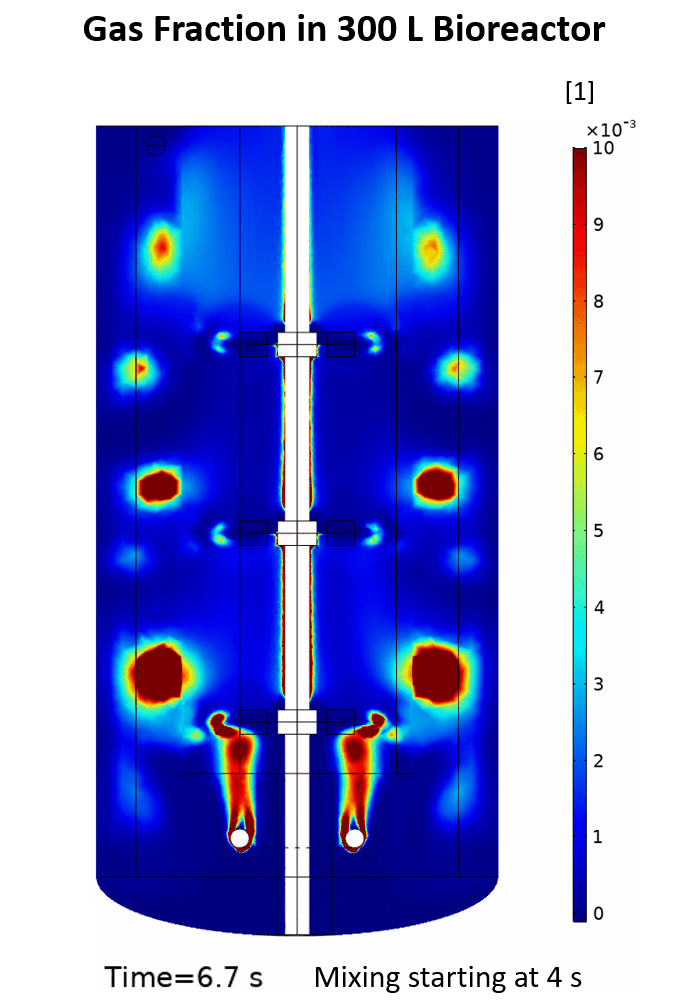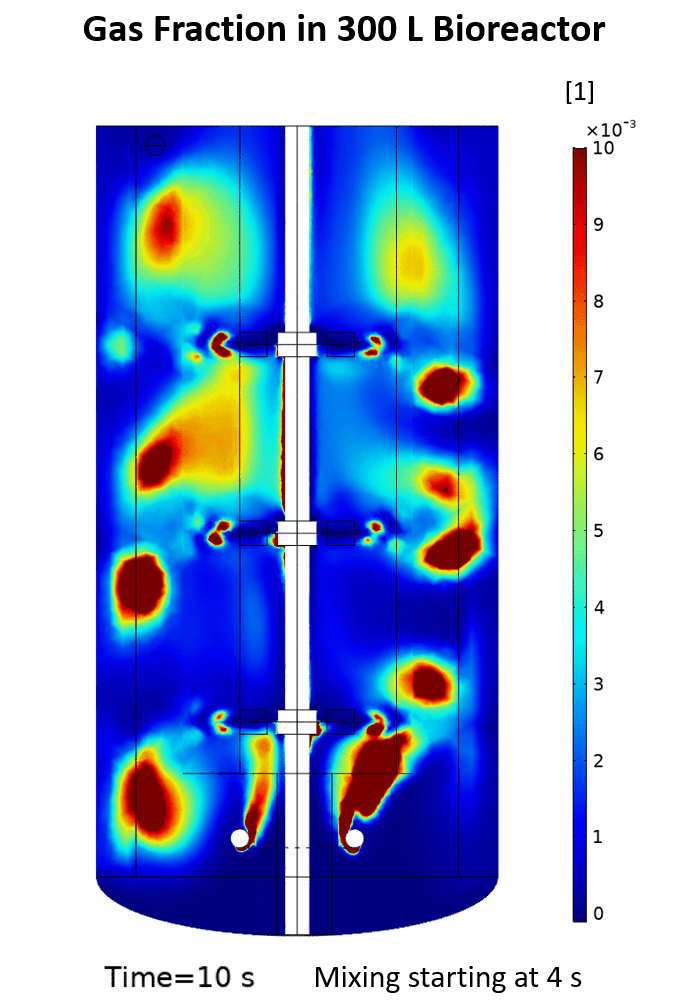
(Quelle: Phuong Ho (IBG-1: Biotechnologie))
Aber woran liegt es genau, dass einige Mikroben dieses Wechselbad – der Bioverfahrenstechniker spricht hierbei von sog. Inhomogenitäten – auf ihrer Reise durch den Reaktor nicht mögen? Ganz sicher liegt es nicht an den auftretenden Beschleunigungskräften, denn die meisten Mikroorganismen halten mechanisch unglaublich viel aus. Ursache ist vielmehr die Herkunft der Mikroben: in ihrem natürlichen Lebensraum hat jede Veränderung der äußeren Bedingungen etwas zu bedeuten. Die Knappheit von Nährstoffen beispielsweise, erfordert eine Umstellung der Ernährung oder das Anlegen von Vorräten um die schlechten Zeiten zu überdauern. Jeder Wechsel in den Umgebungsbedingungen könnte also ein Signal sein, das Anpassungsvorgänge in den Zellen auslöst. Über ein Netzwerk von komplizierte Regelkreisen können so neue Stoffwechselwege eingerichtet und andere abgestellt werden. Solche Anpassungen kosten die Zellen sehr viele Ressourcen und verringern damit die Leistungsfähigkeit der Mikroorgansimen das gewünschte Produkt herzustellen.
Was kann man also tun, um die Maßstabsvergrößerung von Prozessen leichter und vorhersagbarer zu machen und hierfür die besten Mikroben auszusuchen? Dieser Frage gehen die Jülicher Biotechnologen nach und nutzen dafür einen verblüffend einfachen Ansatz. Im einem Standard-Labor-Bioreaktor geht es den Mikroorgansimen offenbar viel zu gut. Man muss die Laborreaktoren also derart modifizieren, dass sie bereits hier das Wechselbad der Produktionsbioreaktoren erleben. Provorziert man schon im Labormaßstab Inhomogenitäten, kann direkt geprüft werden welche Mikroorganismen damit gut zurechtkommen. Die Wissenschaftler sprechen hier von Scale-Down Simulationen. Dabei werden die Mikroben den wechselnden Bedingungen in kurzen Zyklen ausgesetzt, quasi ein biotechnologisches Trainingslager für Mikroben.
So haben die Jülicher zum Beispiel gelernt, dass das Bodenbakterium Corynebacterium glutamicum sehr gutmütig im Hinblick auf die Maßstabsvergrößerung reagiert. Man kann ihm sogar für mehrere Minuten die Atemluft abstellen ohne dass die Alarmsysteme aktiviert und Gegenmaßnahmen eingeleitet werden. Das könnte ein Schlüssel zum Erfolg sein und einer der Gründe warum C. glutamicum heute als Allroundtalent für die weltweite Produktion von jährlich 6 Millionen Tonnen Glutamat (Geschmacksverstärker) und Lysin (Futtermittelzusatz) eingesetzt wird?
Indem die Jülicher Biotechnologen das Wechselbad der Produktionsreaktoren ins Labor geholt haben, können Sie die Leistungsfähigkeit von Mikroben unter Produktionsbedingungen besser vorhersagen und so die Entwicklung von neuen Bioprozessen und Produkten planbarer machen. So weiß man bereits zu einem frühen Zeitpunkt, ob man bei einer Maßstabsvergrößerung auf Überraschungen gefasst sein muss.
Ein Beitrag von E. Zelle, M. Oldiges und W. Wiechert

No Comments
Be the first to start a conversation