Dies ist der zweite Teil des Artikels „Der Vorposten des Gehirns“. Den ersten Teil finden Sie hier.
DIE SPRACHE DER ZELLEN
Noch komplexer wird der Ausflug in die Welt des Sehens, wenn Müller auf Botenstoffe und Ionenkanäle zu sprechen kommt, die molekulare Grundlage der Sprache der Nervenzellen. Hier sieht er enormen Forschungsbedarf. „Unser Team hat beispielsweise gezeigt, dass jeder Bipolarzelltyp ein spezifisches Repertoire von Ionenkanälen hat.“ Ionenkanäle sind Bausteine in der Zellmembran. Durch sie gelangen elektrisch geladene Teilchen – Ionen – in die Zelle und aus ihr heraus. Da sich die Kanäle öffnen und schließen können, steuern sie wie ein Schalter, ob ein elektrisches Signal in Form von Ionen in der Zelle ankommt.
„Jeder Zelltyp hat sein ganz spezielles Inventar von Kanälen, und das prägt das jeweilige typische Antwortverhalten der Zellen“, führt Müller aus. Seine Arbeitsgruppe konnte beispielsweise in Stäbchen einen Ionenkanal nachweisen, den die Forscher salopp „Notbremse“ nennen. Er schaltet das Signal der Stäbchen bei viel Licht ab.
EINGEBAUTER LICHTSCHUTZ
Dazu muss man wissen: Bei Dunkelheit sind die hochempfindlichen Stäbchen aktiv, bei Sonnenschein die Zapfen. Der von Müllers Team untersuchte Ionenkanal wird aktiviert, wenn das Signal in den Stäbchen sehr groß wird – also bei zunehmender Helligkeit, zum Beispiel wenn man aus einem dunklen Raum ins helle Sonnenlicht tritt. Damit die Augen in einer solchen Situation nicht dauerhaft geblendet sind, reduziert der Ionenkanal das Signal der Stäbchen automatisch. „Ohne diesen Kanal wären wir bei bestimmten Beleuchtungsbedingungen praktisch blind“, verdeutlicht Frank Müller.
Aber der miniaturisierte Supercomputer „Auge“ hat noch weitere Schaltkreise: „Das Antwortver halten der Nervenzellen wird nicht nur durch ihre Ionenkanäle bestimmt, sondern auch durch eine breite Palette von Botenstoffen. Sie helfen der Netzhaut unter anderem dabei, ihre Empfindlichkeit an eine enorme Spannbreite von Lichtintensitäten anzupassen“, schildert Müller. „Bei strahlendem Sonnenschein fällt 10 oder 100 Milliarden mal mehr Licht ins Auge als in einer sternenklaren Nacht. Ein Teil dieser Anpassung findet in den Lichtrezeptoren selbst statt, ein anderer Teil im retinalen Netzwerk.“ Und: Verschiedene Nervenzelltypen können auf den gleichen Botenstoff ganz unterschiedlich reagieren. Das beobachten die Forscher mithilfe von Fluoreszenzindikatoren, die sie als leuchtende Spione in  Retinazellen einschleusen. Ein weiteres Indiz für ein komplexes System äußerst fein abgestimmter Schaltkreise, das die Forschung bislang nur ansatzweise versteht.
Retinazellen einschleusen. Ein weiteres Indiz für ein komplexes System äußerst fein abgestimmter Schaltkreise, das die Forschung bislang nur ansatzweise versteht.
In Anbetracht dieser enormen Komplexität im Auge mutet es gewagt an, Blinden das Sehen zurückgeben zu wollen. Und doch ist es genau das, was Ärzte und Wissenschaftler mit Retinaimplantaten anstreben. Sie hoffen, den noch gesunden Teil der Netzhaut mit künstlichen Impulsen anregen zu können. Prof. Peter Walter, Direktor der Universitäts-Augenklinik Aachen und Kooperationspartner von Frank Müller, hat acht Patienten mit Retinitis pigmentosa operiert.
„Wir verwenden den Chip eines US-Herstellers, der auf die Netzhaut aufgesetzt wird“, erläutert er. Der Chip stimuliert die Nervenzellen mit elektrischen Signalen einer Kamera, die in ein Brillengestell integriert ist. Immerhin können die meisten Betroffenen auf diese Weise starke Kontraste wahrnehmen. Von einer echten Sehhilfe ist das System jedoch noch weit entfernt, sind sich Walter und Müller einig. Ein zentrales Problem ist, dass selbst die größten derzeitig verwendeten Chips mit maximal 1.500 Bildpunkten arbeiten. Das so erzeugte Bildfeld ist klein – etwa so groß wie ein Tennisball, der auf eine Armlänge Abstand betrachtet wird – und die Auflösung ist etwa 100-mal schlechter als bei einer gesunden Netzhaut.

Bitte klicken Sie auf das Bild, um es zu vergrößern. Quelle: Seitenplan
EMPFANG GESTÖRT
„Man muss auch berücksichtigen, dass sich die Netzhaut im Verlauf der Krankheit stark umorganisiert, so als würde jemand im Inneren eines Supercomputers hier und dort Kabel umstöpseln“, ergänzt Frank Müller. Seine Arbeitsgruppe hat untersucht, wie sich die Krankheit bei Mäusen entwickelt. „Dabei haben wir krankhafte rhythmische Signalfolgen in der Netzhaut gemessen, die sich mit Phasen normaler Aktivität abwechseln.“ Bisherige Netzhaut-Chips gehen nicht auf diese Veränderungen ein. Sie senden stur ihr Signal an die Nervenzellen. Ist das Netzwerk durch die Krankheit aber stark verändert, können die Nervenzellen möglicherweise nichts mehr mit dem Signal anfangen. Die Teams des Neurobiologen Müller und des Mediziners Walter haben sich deshalb mit Ingenieuren und Elektrotechnikern zusammengeschlossen, etwa mit dem Jülicher Bioelektroniker Prof. Andreas Offenhäusser. Sie entwerfen gemeinsam eine neue Generation von Elektroden für Netzhaut-Implantate.
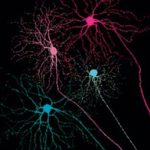
Ganglienzellen leiten die vorgefilterte Information von der Netzhaut ins Gehirn. Man schätzt, dass es 15 bis 30 verschiedene Typen von Ganglienzellen gibt. Sie sind zum Hier wurden vier Ganglienzellen mit Fluoreszenzfarbstoffen gefüllt.
Die Idee: Die Elektroden sollen nicht nur Signale aussenden, um die vorhandenen Nervenzellen zu reizen, sondern auch messen, in welchem Zustand die Netzhaut ist und ob sie die Reize effizient umsetzt. „Wir hoffen, dass wir irgendwann mit solchen bidirektionalen Elektroden krankhafte Aktivität erkennen und durch gezielte Impulse in den Normalzustand zurückversetzen können“, blickt Frank Müller in die Zukunft. Eine Möglichkeit wäre es, gezielt die Nervenzellen anzusteuern, die besonders effektiv auf die künstlichen Signale reagieren. Einen ersten funktionellen Elektroden-Prototypen will die Forschergruppe im Rahmen des von der Deutschen Forschungsgemeinschaft geförderten Projekts „Bidirektionale Kommunikation zwischen Retina-Stimulatoren und Netzhaut“ (BiMEA) bis 2018 vorstellen.
Dies war der zweite Teil des Artikels „Der Vorposten des Gehirns“, den unsere Autorin Brigitte Stahl-Busse für die aktuelle Ausgabe des Magazins effzett geschrieben hat. Den ganzen Text finden Sie auch als gedruckte Ausgabe, als ePaper oder auf dem iPad/Tablet.
www.fz-juelich.de/effzett.

No Comments
Be the first to start a conversation